การค้นพบกัมมันตภาพรังสี
เรนเก็น (roentgen) ค้นพบการแผ่รังสีเอ็กส์ ของแบเรียมที่เรืองแสงทำให้ฟิล์มดำ
เบคเคอเรล (Henri Becquerel) นักฟิสิกส์ชาวฝรั่งเศส
เป็นผู้ค้นพบกัมมันตภาพรังสีในสารประกอบยูเรเนียม เรียกว่า รังสียูเรนิก
ในขณะที่ทำการวิเคราะห์เกี่ยวกับรังสีเอกซ์
กัมมันตภาพรังสีมีสมบัติแตกต่างจากรังสีเอกซ์ คือ มีความเข้มน้อยกว่ารังสีเอกซ์ การแผ่รังสีเกิดขึ้นอย่างต่อเนื่องตลอดเวลาธาตุกัมมันตรังสี
(Radioactive Elements) หมายถึง
ธาตุที่มีในธรรมชาติที่แผ่รังสีออกมาได้เอง
กัมมันตภาพรังสี (Radioactivity) เป็นปรากฎการณ์อย่างหนึ่งของสารที่มีสมบัติในการแผ่รังสีออกมาได้เอง
กัมมันตภาพรังสี ที่แผ่ออกมามีอยู่ 3 ชนิดด้วยกัน คือ รังสีแอลฟา รังสีเบตา
และรังสีแกมมาโดยเมื่อนำสารกัมมันตรังสีใส่ลงในตะกั่วที่เจาะรูเอาไว้ให้รังสีออกทางช่องทางเดียวไป
ผ่านสนามไฟฟ้า พบว่ารังสีหนึ่งจะเบนเข้าหาขั้วบวกคือรังสีเบตา
อีกรังสีหนึ่งเบนเข้าหาขั้วลบคือรังสีแอลฟาหรืออนุภาคแอลฟา
ส่วนอีกรังสีหนึ่งเป็นกลางทางไฟฟ้าจึงไม่ถูกดูดหรือผลักด้วยอำนาจแม่เหล็กหรืออำนาจนำไฟฟ้า
ให้ชื่อรังสีนี้ว่า รังสีแกมมา ดังรูป
รูปแสดงการเบี่ยงเบนของรังสีชนิดต่างๆ ในสนามไฟฟ้า
การเกิดกัมมันตภาพรังสี
1. เกิดจากนิวเคลียสในภาวะพื้นฐาน
รับพลังจำนวนมากทำให้นิวเคลียสกระโดดไปสู่ระดับพลังงานที่สูงขึ้น
ก่อนกลับสู่ภาวะพื้นฐานนิวเคลียร์จะคลายพลังงานออกมาในรูป “ โฟตอนที่มีพลังงานสูง
“ ย่านความถี่รังสีแกมมา
2. เกิดจากการที่นิวเคลียร์บางอัน อยู่ในสภาพไม่เสถียร คือมีอนุภาคบางอนุภาคมากหรือน้อยเกินไป
ลักษณะนี้นิวเคลียร์จะปรับตัว คายอนุภาคเบตาหรือแอลฟาออกมา
ชนิดของกัมมันตภาพรังสี
1) รังสีแอลฟา (Alpha Ray – α) เกิดจากการสลายตัวของนิวเคลียสที่มีขนาดใหญ่และมีมวลมากเพื่อเปลี่ยนแปลงให้เป็นนิวเคลียสที่มีเสถียรภาพสูงขึ้น
ซึ่งรังสีนี้ถูกปล่อยออกมาจากนิวเคลียสด้วยพลังงานต่าง ๆ กัน
รังสีแอลฟาก็คือนิวเคลียสของฮีเลียม แทนด้วย
มีประจุบวกมีขนาดเป็น 2 เท่าของประจุอิเล็กตรอน คือเท่ากับ +2e และมีนิวตรอน อีก 2 นิวตรอน (2n) มีมวลเท่ากับนิวเคลียสของฮีเลียมหรือประมาณ
7000 เท่าของอิเล็กตรอน เนื่องจากมีมวลมากจึงไม่ค่อยเกิดการเบี่ยงเบนง่ายนัก
เมื่อวิ่งไปชนสิ่งกีดขวางต่าง ๆ เช่น ผิวหนัง แผ่นกระดาษ จะไม่สามารถผ่านทะลุไปได้
แต่จะถูกดูดซึมได้อย่างรวดเร็วแล้วจะถ่ายทอดพลังงานเกือบทั้งหมดออกไป
ทำให้อิเล็กตรอนของอะตอมที่ถูกรังสีแอลฟาชนหลุดออกไป
ทำให้เกิดกระบวนการที่เรียกว่า การแตกตัวเป็นไอออน
แสดงการสลายตัวของสารแล้วให้รังสีแอลฟา
สมการการสลายตัวของสารกัมมันตรังสีที่ให้รังสีแอลฟา เป็นดังนี้
จากรูป 

 +
+ 
2) รังสีเบตา (Beta Ray – β) เกิดจากการสลายตัวของนิวไคลด์ที่มีจำนวนโปรตอนมากเกินไปหรือน้อยเกินไป
โดยรังสีเบตาแบ่งได้ 2 แบบคือ
1. เบตาลบหรือหรืออิเล็กตรอน
ใช้สัญลักษณ์ หรือ
เกิดจากการสลายตัวของนิวเคลียสที่มีนิวตรอนมากกว่าโปรตอน
ดังนั้นจึงต้องลดจำนวนนิวตรอน ลงเพื่อให้นิวเคลียสเสถียรภาพ
แสดงการสลายตัวของสารแล้วให้รังสีเบตาลบ
สมการการสลายตัวของสารกัมมันตรังสีที่ให้รังสีเบตาลบ เป็นดังนี้
จากรูป 

 +
+ 
2. เบตาบวกหรือหรือโพสิตรอน
ใช้สัญลักษณ์ หรือ
เกิดจากการสลายตัวของนิวเคลียสที่มีโปรตอนมากเกินกว่านิวตรอน
ดังนั้นจึงต้องลดจำนวนโปรตอนลงเพื่อให้นิวเคลียสเสถียรภาพ
แสดงการสลายตัวของสารแล้วให้รังสีเบตาบวก
สมการการสลายตัวของสารกัมมันตรังสีที่ให้รังสีเบตาบวก เป็นดังนี้
จากรูป 

 +
+ 
เนื่องจากอิเล็กตรอนนั้นเบามาก
จึงทำให้รังสีเบตาเกิดการเบี่ยงเบนได้ง่าย
สามารถเบี่ยงเบนในสนามไฟฟ้าและสนามแม่เหล็กได้ มีความเร็วสูงมากคือมากกว่าครึ่งของ
ความเร็วแสงหรือประมาณ 300,000 กิโลเมตรต่อวินาที
มีอำนาจในการทะลุทะลวงมากกว่ารังสีแอลฟา แต่น้อยกว่ารังสีแกมมา
3) รังสีแกมมา(Gamma Ray) ใช้สัญลักษณ์
γ เกิดจากการที่นิวเคลียสที่อยู่ในสถานะกระตุ้นกลับสู่สถานะพื้นฐานโดยการปลดปล่อยรังสีแกมมาออกมา
รังสีแกมมา ก็คือโฟตอนของการแผ่คลื่นแม่เหล็กไฟฟ้าเช่นเดียวกับรังสีเอ็กซ์
แต่มีความยาวคลื่นสั้นกว่าและมีอำนาจในการทะลุทะลวงสูงมากกว่ารังสีเอ็กซ์
ไม่มีประจุไฟฟ้าและมวล ไม่เบี่ยงเบนในสนามไฟฟ้าและสนามแม่ เหล็กและ
เคลื่อนที่ด้วยความเร็วเท่าแสง
แสดงการสลายตัวของสารแล้วให้รังสีแกมมา
สมการการสลายตัวของสารกัมมันตรังสีที่ให้รังสีแกมมา เป็นดังนี้
จากรูป 

 +
+ 
การวิเคราะห์ชนิดของประจุของสารกัมมันตภาพรังสีโดยใช้สนามแม่เหล็ก
จะเห็นได้ว่า α เบนในสนามแม่เหล็ก
เหมือนกับมีประจุเป็นบวก
β เบนในสนามแม่เหล็ก
เหมือนกับมีประจุเป็นลบ
γ ไม่เบนเลย
(แสดงว่าไม่มีประจุไฟฟ้า)
สมบัติของกัมมันตภาพรังสี α , β , γ
1. อนุภาค α (α – particles) คือนิวเคลียสของอะตอมของธาตุฮีเลียมซึ่งประกอบด้วยโปรตอน
2 อนุภาค และนิวตรอน 2 อนุภาค
2. อนุภาค β (β – particle ) คืออิเล็กตรอน
เป็นอนุภาคมีมวล , มีประจุไฟฟ้าลบ , เคลื่อนที่ด้วยความเร็วสูงมากเกือบเท่าความเร็วแสง
, มีมวลน้อยมากเมื่อเทียบกับอำนาจทะลุทะลวงปานกลาง
3. รังสี γ ( γ – gamma rays ) เป็นคลื่นแม่เหล็กไฟฟ้ามีความยาวช่วงคลื่นสั้นมาก
, ความถี่สูง (มากกว่ารังสี X ) มีความเร็วเท่ากับแสงในสูญญากาศ
, มีอำนาจทะลวงสูง , ไม่มีประจุไฟฟ้า (
จึงไม่เบี่ยงเบนในสนามไฟฟ้าหรือในสนามแม่เหล็ก ) ผ่านคอนกรีตหนา หนึ่งส่วนสามเมตร
ได้เช่นเดียวกับรังสีเอกซ์
สรุป
1. สรุปอนุภาค α
มีประจุ + 2 , มีมวล 4 amu
มีอัตราเร็ว 1/15 ความเร็วแสง
มีอำนาจทะลุทะลวงน้อยกว่ารังสีอื่น
2. สรุปอนุภาค β
คือ electron , มีมวลน้อยมาก , ประจุ
– 1
ความเร็วสูงมาก เกือบเท่าความเร็วแสง
อำนาจทะลุทะลวงปานกลาง
3. สรุปรังสี γ
เป็นคลื่นแม่เหล็กไฟฟ้า , มีความถี่สูงสุด
มีความเร็วเท่าแสง
อำนาจทะลุทะลวงสูง
การเปลี่ยนสภาพนิวเคลียส
ในการศึกษาธาตุกัมมันตรังสีต่างๆ พบว่า
เวลามีการแผ่รังสีแอลฟาหรือรังสีเบตาจะมีธาตุใหม่เกิดขึ้นเสมอ
จึงกล่าวได้ว่ารังสีเหล่านี้เกิดจากการเปลี่ยนสภาพของนิวเคลียส
ดังนั้นการศึกษากัมมันตภาพรังสีจะทำให้รู้องค์ประกอบของนิวเคลียสได้
โครงสร้างของนิวเคลียส
ภายในอะตอมประกอบด้วยนิวเคลียสและอิเล็กตรอน
ซึ่งภายในนิวเคลียสมีอนุภาคหลักอยู่ 2 ชนิดคือ โปรตอนและนิวตรอน
ดังรูป
แสดงอนุภาคภายในนิวเคลียส
โดยอนุภาคทั้งสามในอะตอมเป็นดังนี้
1. โปรตอน มีประจุบวก โดยขนาดของประจุเท่ากับ 1.6×10-19
C และโดยมีมวลนิ่ง 1.67252 x 10-27 kg หรือมีค่าเท่ากับ 1.007277 u สัญลักษณ์ของโปรตอนแทนด้วย
2. นิวตรอน มีอนุภาคที่เป็นกลางทางไฟฟ้า ไม่มีประจุ และโดยมีมวลนิ่ง 1.67482 x 10-27 kg หรือมีค่าเท่ากับ 1.008665 u สัญลักษณ์ของนิวตรอนแทนด้วย
3. อิเล็กตรอน มีประจุลบ โดยขนาดของประจุเท่ากับ 1.6×10-19
C และโดยมีมวลนิ่ง 9.1×10-31 kg หรือมีค่าเท่ากับ 0.000548 u สัญลักษณ์ของอิเล็กตรอนแทนด้วย
การค้นพบนิวตรอน
จากแนวคิดของรัทเธอร์ฟอร์ดที่เสนอว่า นิวเคลียส น่าจะประกอบด้วย
โปรตอนและนิวตรอน
โดยนิวตรอนเป็นอนุภาคที่เกิดจากการรวมตัวกันของโปรตอนและอิเล็กตรอน อนุภาคนิวตรอนจะเป็นกลางทางไฟฟ้า
การค้นหาว่ามีอนุภาคนิวตรอนนั้นเป็นเรื่องที่ทำได้ยากมาก เพราะการทดสอบส่วนใหญ่มักจะทดสอบด้วยสนามแม่เหล็กและสนามไฟฟ้า
ส่วนอนุภาคนิวตรอนไม่มีประจุย่อมไม่เบี่ยงเบนในสนามทั้งสอง
หลังจากมีการพยายาม พบว่ามีการทดลองหนึ่ง
คือยิงอนุภาคแอลฟาไปที่อะตอมของเบริลเลียม จะมีปลดปล่อยรังสีหนึ่งออกมามีสมบัติคล้ายรังสีแกมมา
เพราะเป็นกลางทางไฟฟ้า
สามารถทะลุทะลวงในวัตถุได้ดี
แต่เมื่อทดสอบในเรื่องพลังงาน พบว่ารังสีมีพลังงานมากกว่ารังสีแกมมา
แชดวิค
เป็นคนที่ทดลองและสรุปการชนของรังสีนี้ชนกับพาราฟินเปรียบเทียบกับให้รังสีแกมมาชนพาราฟิน
แล้วตรวจสอบความเร็ว
พบว่าการชนของรังสีที่สงสัยกับพาราฟินเป็นการชนของอนุภาคชนกับอนุภาค
จึงสรุปว่า รังสีนี้ คือ
อนุภาคนิวตรอน
ซึ่งเป็นการสนับสนุนแนวคิดของรัทเธอร์ฟอร์ด
ที่ว่าอนุภาคนิวตรอนเป็นอนุภาคที่เป็นกลางที่อยู่ในนิวเคลียส
การสลายกัมมันตรังสี
สมมติฐานการสลายตัวของธาตุกัมมันตรังสี ของรัทเทอร์ฟอร์ดและซอดดี (Soddy)กล่าวว่า
1. การสลายตัวของธาตุกัมมันตรังสีเป็นการสลายตัวที่เกิดขึ้นเอง โดยไม่ขึ้นกับสภาวะแวดล้อมของนิวเคลียส (เช่น
การจัดตัวของอิเลคตรอน ความดัน อุณหภูมิ)
2. การสลายตัวเป็นกระบวนการสุ่ม (Random Process) ในช่วงเวลาใดๆ
ทุกๆ นิวเคลียสมีโอกาสที่จะสลายตัวเท่ากัน
ดังนั้น ในช่วงเวลาหนึ่งๆ
ปริมาณนิวเคลียสที่สลายตัวจึงเป็นสัดส่วนโดยตรงกับปริมาณนิวเคลียสที่เหลืออยู่
อัตราการสลายของนิวเคลียสของธาตุกัมมันตรังสี
ในขณะหนึ่งจะแปรผันตรงกับจำนวนนิวเคลียสของธาตุกัมมันตรังสีนั้นที่มีอยู่ในขณะนั้น
สูตร
โดย λ เป็นค่าคงที่ของการแปรผัน
เรียก ค่าคงตัวการสลาย (decay constant)
อัตราการแผ่รังสีออกมาในขณะหนึ่ง คือ กัมมันตภาพ(activity) มีสัญลักษณ์ A
A = λN
หน่วยวัดกัมมันตภาพ
นิยมวัดเป็นหน่วยคูรี่ โดย Bq (เบคเคอเรล)
การหาจำนวนนิวเคลียสเมื่อเทียบกับฟังก์ชันของเวลา
กราฟแสดงการลดจำนวนนิวเคลียสของธาตุกัมมันตรังสี
ณ เวลาต่างๆ
- ช่วงเวลาของการสลายที่จำนวนนิวเคลียสลดลงเหลือครึ่งหนึ่งของจำนวนเริ่มต้น
เรียกว่า ครึ่งชีวิต (Half Life) มีสัญลักษณ์ 
สูตร 
- การหาจำนวนนิวเคลียสโดยตรงนั้นทำได้ยาก นิยมวัดจากกัมมันตภาพที่แผ่ออกมาดังสูตร

- สภาพสมดุลของธาตุกัมมันตรังสี
หมายถึง
ในธรรมชาติมีธาตุกัมมันตรังสีที่สลายตัวแล้วกลายเป็นนิวเคลียสของธาตุใหม่ แต่ธาตุใหม่ที่ได้นี้ยังไม่เสถียรภาพทีเดียว จึงเกิดการสลายต่อไป จะพิจารณากรณีธาตุ A สลายตัวให้ธาตุ
B สลายตัวให้ธาตุ C สูตรคือ
กราฟแสดงอัตราการสลายของธาตุ
A จะเท่ากับอัตราการเกิดของธาตุ B
เมื่อเวลาเพิ่มขึ้นปริมาณนิวเคลียสของธาตุกัมมันตรังสีจะลดลงเรื่อยๆ แต่ปริมาณนิวเคลียสจะไม่ลดลงเป็นศูนย์ ไม่ว่าเวลาจะผ่านไปเท่าใดก็ตาม การพูดถึงเวลาที่ธาตุกัมมันตรังสีสลายตัวหมดจึงไม่มีความหมาย
ในทางทฤษฎีจึงพูดถึงเวลาที่ธาตุสลายตัวเหลือเป็นครึ่งหนึ่งของปริมาณเดิม
สมการการสลายตัวของสารกัมมันตรังสี
จากการทดลองพบว่าอัตราการสลายตัวของนิวเคลียสจะเป็นปฏิภาคกับจำนวนนิวเคลียสที่มีอยู่ขณะนั้น
เขียนเป็นสมการได้ว่า

หรือ 

โดยที่ λ แทนค่าคงที่ของการสลายตัว (decay constant)
ถ้าให้  เป็นจำนวนนิวเคลียสเริ่มต้นที่เวลา t = 0 และ
เป็นจำนวนนิวเคลียสเริ่มต้นที่เวลา t = 0 และ  เป็นจำนวนนิวเคลียสที่เหลือ เมื่อเวลาผ่านไป t จะได้
เป็นจำนวนนิวเคลียสที่เหลือ เมื่อเวลาผ่านไป t จะได้



การสลายตัวของสารกัมมันตรังสีแสดงได้ดังรูป
กราฟการสลายตัวของสารกัมมันตรังสี
ครึ่งชีวิตของธาตุ
การสลายตัวของธาตุกัมมันตรังสีชนิดหนึ่ง ๆ จะแสดงลักษณะที่แตกต่างกันด้วยเวลาของการสลายตัวที่เรียกว่า ครึ่งชีวิต (Half – Life) แทนด้วย  ซึ่งหมายถึงช่วงเวลาที่ธาตุมันตรังสีหนึ่งจะสลายไปเหลือเพียงครึ่งหนึ่งของปริมาณที่มีอยู่เดิม ซึ่งจากกราฟ พบว่า
ซึ่งหมายถึงช่วงเวลาที่ธาตุมันตรังสีหนึ่งจะสลายไปเหลือเพียงครึ่งหนึ่งของปริมาณที่มีอยู่เดิม ซึ่งจากกราฟ พบว่า
ในเวลาเริ่มต้น t = 0 จำนวนนิวไคล์ทั้งหมดเป็น 
เมื่อเวลาผ่านไปครึ่งชีวิต t = T½ จำนวนนิวไคล์ที่เหลือเป็น 
และเมื่อเวลาผ่านไป t = 2T½ จำนวนนิวไคล์ที่เหลือเป็น 
ข้อควรจำ
ในทางปฏิบัติการวัดหาจำนวนนิวเคลียสโดยตรงกระทำได้ยาก และเนื่องจากจำนวนนิวเคลียสในสารหนึ่ง ๆ จะเป็นสัดส่วนกับปริมาณของสารนั้น ๆ ดังนั้นจึงพิจารณาเป็นค่ากัมมันตภาพหรืการวัดมวลแทน ดังนี้
กัมมันตภาพที่เวลาใด ๆ  =
= 
โดยที่ โดยที่  คือกัมมันตภาพที่เวลาเริ่มต้น (t=0)
คือกัมมันตภาพที่เวลาเริ่มต้น (t=0)
มวลที่เวลาใดๆ  =
= 
โดยที่  คือมวลสารตั้งต้นที่เวลาเริ่มต้น (t=0)
คือมวลสารตั้งต้นที่เวลาเริ่มต้น (t=0)
การหาจำนวนนิวเคลียสสามารถทำได้ดังนี้
ถ้า M แทนมวลอะตอมของธาตุ (กรัมต่อโมล)
m แทนมวลของธาตุ (กรัม)
 แทนเลขอะโวกาโดร = 6.02×10²³ อะตอมต่อโมล
แทนเลขอะโวกาโดร = 6.02×10²³ อะตอมต่อโมล
N แทนจำนวนอะตอม (อะตอม)
m แทนมวลของธาตุ (กรัม)
N แทนจำนวนอะตอม (อะตอม)
จะได้ว่า  =
= 
เสถียรภาพของนิวเคลียส
แรงนิวเคลียร์
จากการศึกษานิวเคลียส สรุปได้ว่าแรงที่ยึดเหนี่ยวนิวคลีออนเข้าด้วยกัน คือ แรงนิวเคลียร์
แรงนิวเคลียร์ คือ แรงที่ใช้ยึดเหนี่ยวนิวคลีออนเข้าด้วยกัน ซึ่งไม่ใช่ทั้งแรงระหว่างประจุและแรงดึงดูดระหว่างมวล แต่เป็นแรงที่เกิดจากการแลกเปลี่ยนอนุภาคเมซอนระหว่างนิวคลีอออนในนิวเคลียส
มวลและพลังงาน
เนื่องจากอะตอมมีขนาดเล็กมาก ในการวัดมวลใน 1 หน่วยอะตอม (atomic mass unit) แทนด้วย u โดยใช้มวลของคาร์บอน-12 เป็นค่ามาตรฐานในการเปรียบเทียบ หาค่ามวลอะตอมอื่น ๆ โดยที่ มวล 1 u มีค่าเท่ากับ  ของมวลคาร์บอน-12 1 อะตอม เขียนได้ว่า
ของมวลคาร์บอน-12 1 อะตอม เขียนได้ว่า
1 u =  มวลของคาร์บอน -12 1 อะตอม
มวลของคาร์บอน -12 1 อะตอม
=  กรัม
กรัม
=  กิโลกรัม
กิโลกรัม
จากทฤษฎีของไอสไตน์กล่าวว่า มวลสามารถเปลี่ยนเป็นพลังงานได้ตามความสัมพันธ์
แทนค่าจะได้ = 
= 
โดยที่  (อิเล็กตรอนโวลต์)
(อิเล็กตรอนโวลต์)
=  eV = 931 MeV
eV = 931 MeV
ดังนั้นจะได้ 1 u = 931 MeV
นั่นคือ มวล 1 u เทียบได้กับพลังงาน 931 MeV
เสถียรภาพของนิวเคลียส คือ เสถียรภาพของนิวคลียสขึ้นอยู่กับพลังงานยึดเหนี่ยวต่อนิวคลีออน นิวเคลียสใดมีพลังงานยึดเหนี่ยวต่อนิวคลีออนสูงจะมีเสถียรภาพสูง
พลังงานยึดเหนี่ยว
พลังงานยึดเหนี่ยว (Binding Energy)คือ“พลังงานที่ใช้ในการยึดนิวคลีออน เข้าได้ด้วยกันในนิวเคลียสของธาตุ” หรือเป็น “พลังงานที่น้อยที่สุด ที่สามารถทำให้นิวเคลียสแตกตัวเป็นองค์ประกอบย่อย”

การที่โปรตอนและนิวตรอนสามารถอยู่กันได้ในนิวเคลียส, เพราะมีพลังงานยึดเหนี่ยว
1. มวลของนิวเคลียสน้อยกว่า ผลรวมของมวลโปรตอนและนิวตรอน (ในสภาพอิสระ) ที่ประกอบเป็น นิวเคลียสเสมอ
2. มวลส่วนที่หายไป เรียกว่า mass defect (Δm)
3. เทียบมวลเป็นพลังงานได้จาก E=mc²
มวลพร่อง (mass defect) หมายถึงมวลส่วนหนึ่งที่หายไป โดยเมื่อนิวคลีออนอิสระมารวมกันเป็นนิวเคลียส มวลของนิวเคลียสที่เกิดขึ้นใหม่จะมีมวลน้อยกว่า ผลรวมของมวลนิวคลีออนอิสระก่อนรวม
1. มวลของนิวเคลียสน้อยกว่า ผลรวมของมวลโปรตอนและนิวตรอน (ในสภาพอิสระ) ที่ประกอบเป็น นิวเคลียสเสมอ
2. มวลส่วนที่หายไป เรียกว่า mass defect (Δm)
3. เทียบมวลเป็นพลังงานได้จาก E=mc²
มวลพร่อง (mass defect) หมายถึงมวลส่วนหนึ่งที่หายไป โดยเมื่อนิวคลีออนอิสระมารวมกันเป็นนิวเคลียส มวลของนิวเคลียสที่เกิดขึ้นใหม่จะมีมวลน้อยกว่า ผลรวมของมวลนิวคลีออนอิสระก่อนรวม
ถ้าให้ M แทนนิวเคลียสที่มีเลขมวล A และเลขอะตอมเป็น Z ซึ่ง Z คือจำนวนประจุบวกซึ่งแต่ละประจุมีมวล  และ (A-Z) แทนจำนวนนิวตรอนซึ่งแต่ละตัวมีมวล
และ (A-Z) แทนจำนวนนิวตรอนซึ่งแต่ละตัวมีมวล  ดังนั้นจะคำนวณหามวลพร่องได้ดังนี้
ดังนั้นจะคำนวณหามวลพร่องได้ดังนี้
โดย พลังงานยึดเหนี่ยว นี้เปลี่ยนรูปมาจากมวลพร่อง นั่นเองโดยการหาค่าพลังงานยึดเหนี่ยวได้จาก การเปลี่ยนแปลงของมวลเปลี่ยนเป็นพลังงาน โดยถ้าให้ B.E. แทนพลังงานยึดเหนี่ยว มีหน่วยเป็นเมกกะอิเล็กตรอนโวลต์ (MeV) และ  แทนมวลพร่อง มีหน่วยเป็น u โดยที่ มวล 1 u เทียบเท่ากับพลังงาน 931 MeV ดังนั้นจะได้
แทนมวลพร่อง มีหน่วยเป็น u โดยที่ มวล 1 u เทียบเท่ากับพลังงาน 931 MeV ดังนั้นจะได้
ตัวอย่าง เช่น  เกิดจาก โปรตอน 2 ตัว และนิวตรอน 2 ตัว ดังสมการ
เกิดจาก โปรตอน 2 ตัว และนิวตรอน 2 ตัว ดังสมการ
จะได้  +
+  = 2(1.0073u) + 2(1.0087u) = 4.0320 u
= 2(1.0073u) + 2(1.0087u) = 4.0320 u
มวลหลังจากรวม  = 4.0015 u
= 4.0015 u
ดังนั้นมวลพร่อง  = (4.0320 u) – (4.0015 u) = 0.0305 u
= (4.0320 u) – (4.0015 u) = 0.0305 u
พลังงานยึดเหนี่ยว  =
= 
= 0.0305 x 931 MeV = 28.39 MeV
พลังงานยึดเหนี่ยวของ  มีค่าเท่ากับ 28.39 MeV
มีค่าเท่ากับ 28.39 MeV
ปฏิกิริยานิวเคลียร์
ปฏิกิริยานิวเคลียร์ (Nuclear Reaction) คือ กระบวนการที่นิวเคลียสเกิดการเปลี่ยนแปลงองค์ประกอบซึ่งเกิดจากการยิงด้วยนิวคลีออน หรือกลุ่มนิวคลีออน หรือรังสีแกมมา แล้วทำให้มีนิวคลีออนเพิ่มเข้าไปในนิวเคลียสหรือออกไปจากนิวเคลียสหรือเกิดการเปลี่ยนแปลงจัดตัวใหม่ภายในนิวเคลียส สามารถเขียนสมการของปฏิกิริยาได้ดังนี้
โดยที่ X เป็นนิวเคลียสที่เป็นเป้า , a คืออนุภาคที่วิ่งเข้าชนเป้า , b คืออนุภาคที่เกิดขึ้นใหม่หลังจากการชน และ Y คือนิวเคลียสของธาตุใหม่หลังจากการชน
เช่น  แสดงถึงว่า
แสดงถึงว่า  เป็นนิวเคลียสเป้าหมายที่ถูกยิง
เป็นนิวเคลียสเป้าหมายที่ถูกยิง  เป็นนิวเคลียสของธาตุใหม่ที่เกิดขึ้น n คือนิวตรอนเป็นอนุภาคที่ใช้ในการยิง และ เป็นรังสีที่เกิดขึ้นใหม่ เป็นต้น
เป็นนิวเคลียสของธาตุใหม่ที่เกิดขึ้น n คือนิวตรอนเป็นอนุภาคที่ใช้ในการยิง และ เป็นรังสีที่เกิดขึ้นใหม่ เป็นต้น
ปฏิกิริยานิวเคลียร์ ส่วนมากเกิดจากการยิงอนุภาคแอลฟา โปรตอนและนิวตรอนเข้าไปในชน Nucleus ทำให้ Nucleus แตกออก ปฏิกิริยานิวเคลียร์ มีส่วนสำคัญคือ
1. ปฏิกิริยา Nuclear เกิดในนิวเคลียส ต่างจากปฏิกิริยาเคมี ซึ่งเกิดกับอิเลกตรอนภายในอะตอม
2. ปฏิกิริยา Nuclear ต้องใช้พลังงานเป็นจำนวนมากเพื่อจะทำให้เกิดการเปลี่ยนแปลงนิวเคลียส
3. แรงจากปฏิกิริยา Nuclear เป็นแรงแบบใหม่ เรียก แรงนิวเคลียร์ ซึ่งมีอันตรกริยาสูง และอาณาเขตกระทำสั้นมากและแรงนี้เกิดระหว่างองค์ประกอบของนิวเคลียสเท่านั้น
4. ในปฏิกิริยานิวเคลียส เราสามารถนำกฎต่างๆ มาใช้ได้เป็นอย่างดี คือ กฎการคงที่ของพลังงาน กฎทรงมวล และการคงที่ของประจุไฟฟ้า
1. ปฏิกิริยา Nuclear เกิดในนิวเคลียส ต่างจากปฏิกิริยาเคมี ซึ่งเกิดกับอิเลกตรอนภายในอะตอม
2. ปฏิกิริยา Nuclear ต้องใช้พลังงานเป็นจำนวนมากเพื่อจะทำให้เกิดการเปลี่ยนแปลงนิวเคลียส
3. แรงจากปฏิกิริยา Nuclear เป็นแรงแบบใหม่ เรียก แรงนิวเคลียร์ ซึ่งมีอันตรกริยาสูง และอาณาเขตกระทำสั้นมากและแรงนี้เกิดระหว่างองค์ประกอบของนิวเคลียสเท่านั้น
4. ในปฏิกิริยานิวเคลียส เราสามารถนำกฎต่างๆ มาใช้ได้เป็นอย่างดี คือ กฎการคงที่ของพลังงาน กฎทรงมวล และการคงที่ของประจุไฟฟ้า
ข้อควรจำ
1. ในสมการของปฏิกิริยานิวเคลียร์ทั้งหลายที่เกิดขึ้น ผลรวมของเลขอะตอมก่อนเกิดปฏิกิริยาและภายหลังปฏิกิริยาย่อมเท่ากัน และผลรวมของมวลอะตอมก่อนเกิดปฏิกิริยาและภายหลังปฏิกิริยาย่อมเท่ากัน เช่น ปฏิกิริยา 
เขียนได้เป็น 



เลขอะตอมคือ 7 + 2 = 8 + 1
มวลอะตอมคือ 14 + 4 = 17 + 1
2. ในปฏิกิริยานิวเคลียร์นั้นพลังงาน หรือ มวล-พลังงาน (mass – energy) ก่อนปฏิกิริยาและหลังปฏิกิริยาจะต้องเท่ากันเสมอ ซึ่งเป็นไปตามกฎทรงพลังงาน ดังเช่น ในการยิงอนุภาคโปรตอนไปยังนิวเคลียสของลิเทียมแล้วทำให้เกิดนิวเคลียสของฮีเลียม 2 นิวเคลียส ดังสมการ
โดยที่  มีมวล 7.0160 u
มีมวล 7.0160 u  มีมวล 4.0026 u
มีมวล 4.0026 u
มวลก่อนเกิดปฏิกิริยา  = 7.0160 u + 1.0078 u = 8.0238 u
= 7.0160 u + 1.0078 u = 8.0238 u
มวลหลังเกิดปฏิกิริยา  = 4.0026 u + 4.0026 u = 8.0052 u
= 4.0026 u + 4.0026 u = 8.0052 u
มวลรวมก่อนเกิดปฏิกิริยามากกว่ามวลรวมหลังปฏิกิริยา = 8.0238 u – 8.0052 u = 0.0186 u
แต่มวลสามารถเปลี่ยนเป็นพลังงานได้โดย E = 0.0186 u × 931 MeV = 17.32 MeV
โดยพลังงานที่ให้ออกมาอยู่ในรูปคลื่นแม่เหล็กไฟฟ้าที่ออกมาจากปฏิกิริยานิวเคลียร์ จึงเรียก ว่าพลังงานนิวเคลียร์ ดังนั้นเขียนสมการข้างต้นใหม่ได้ว่า
ปฏิกิริยานิวเคลียร์บางปฏิกิริยาต้องดูดพลังงานเข้าไปจึงจะเกิดปฏิกิริยาขึ้นได้ เช่น ปฏิกิริยา  เขียนเป็นสมการได้
เขียนเป็นสมการได้
โดยที่  มีมวล = 14.003074 u
มีมวล = 14.003074 u  มีมวล = 4.002603 u
มีมวล = 4.002603 u
มวลก่อนเกิดปฏิกิริยา  = 14.003074 u + 4.002603 u = 18.005677 u
= 14.003074 u + 4.002603 u = 18.005677 u
มวลหลังเกิดปฏิกิริยา  = 18.005677 u + 1.007825 u = 18.006958 u
= 18.005677 u + 1.007825 u = 18.006958 u
ผลต่างของพลังงานก่อนเกิดปฏิกิริยากับหลังเกิดปฏิกิริยามีค่าดังนี้
E = (18.005677 u – 18.006958 u) × 931MeV = -1.193 MeV
ดังนั้น เพื่อทำให้เกิดปฏิกิริยานิวเคลียร์นี้ขึ้นจะต้องให้พลังงานแก่  โดยเขียนเป็นสมการได้
โดยเขียนเป็นสมการได้
สรุปปฏิกิริยานิวเคลียร์
1. การหานิวเคลียสของธาตุจากปฏิกิริยา ใช้หลักดังนี้
 ผลรวมของประจุทางซ้ายมือและขวามือของสมการมีค่าเท่ากัน
ผลรวมของประจุทางซ้ายมือและขวามือของสมการมีค่าเท่ากัน จำนวนนิวคลีออนทางซ้ายมือและขวามือของสมการมีค่าเท่ากัน
จำนวนนิวคลีออนทางซ้ายมือและขวามือของสมการมีค่าเท่ากัน2. การคำนวณพลังงานจากปฏิกิริยานิวเคลียร์ มีหลักดังนี้
 ถ้ามวลรวมก่อนเกิดปฏิกิริยา > มวลรวมหลักเกิดปฏิกิริยา ; ปฏิกิริยานี้จะคายพลังงาน
ถ้ามวลรวมก่อนเกิดปฏิกิริยา > มวลรวมหลักเกิดปฏิกิริยา ; ปฏิกิริยานี้จะคายพลังงานถ้ามวลรวมก่อนเกิดปฏิกิริยา < มวลรวมหลังเกิดปฏิกิริยา ; ปฏิกิริยานี้จะดูดพลังงาน
 พลังงานที่คายหรือดูดจะหาได้จาก ผลต่างของมวลรวมก่อนทำปฏิกิริยากับหลังทำปฏิกิริยาคูณด้วย 931 โดยมวลอยู่ในหน่วย amu และพลังงานอยู่ในหน่วย MeV
พลังงานที่คายหรือดูดจะหาได้จาก ผลต่างของมวลรวมก่อนทำปฏิกิริยากับหลังทำปฏิกิริยาคูณด้วย 931 โดยมวลอยู่ในหน่วย amu และพลังงานอยู่ในหน่วย MeV มวลที่ใช้อาจเป็นมวลนิวเคลียสโดยตรง หรือ มวลอะตอมก็ต้องเป็นมวลอะตอมหมดจะปนกันไม่ได้
มวลที่ใช้อาจเป็นมวลนิวเคลียสโดยตรง หรือ มวลอะตอมก็ต้องเป็นมวลอะตอมหมดจะปนกันไม่ได้นิวเคลียสก็ต้องเป็นนิวเคลียสหมด หรือมวลอะตอมก็ต้องเป็นมวลอะตอมหมดจะปนกันไม่ได้
ปฏิกิริยาฟิชชัน
ปฏิกิริยาฟิชชั่น (Fission) เป็นปฏิกิริยาแยกตัวของนิวเคลียส โดยมีนิวตรอนเป็นตัววิ่งเช้าชนนิวเคลียสหนัก (A>230) เป็นผลทำให้ได้นิวเคลียสที่มีขนาดปานกลาง และมีนิวตรอนที่มีความเร็วสูงเกิดขึ้นประมาณ 2-3 ตัว ทั้งมีการคายพลังงานออกมาด้วย เช่น ปฏิกิริยาลูกโซ่
การเกิดปฏิกิริยาการแตกตัว
ตัวอย่างการแบ่งแยกนิวเคลียส เช่น การยิงนิวตรอนไปยังนิวเคลียสของ  ซึ่งจะแตกออกเป็น 2 ส่วนเกือบเท่ากัน คือ เกิดนิวเคลียสของแบเรียมและคริปตัน ดังสมการ
ซึ่งจะแตกออกเป็น 2 ส่วนเกือบเท่ากัน คือ เกิดนิวเคลียสของแบเรียมและคริปตัน ดังสมการ
เตาปฏิกรณ์นิวเคลียร์ (Nuclear Reactor) เป็นเครื่องมือที่ใช้ในการผลิตพลังงานนิวเคลียร์ โดยที่เราสามารถควบคุมการเกิดฟิชชั่นและปฏิกิริยาลูกโซ่ได้ พลังงานที่ได้เราสามารถนำไปใช้ในการผลิตกระแสไฟฟ้าได้
ปฏิกิริยาฟิวชัน
ปฏิกิริยาฟิวชั่น (Fusion) เป็นปฏิกิริยาหลอมตัวของนิวเคลียสและมีพลังงานคายออกมาด้วย นิวเคลียสที่ใช้หลอดจะต้องเป็นนิวเคลียสเล็กๆ (A<20) หลอมรวมกลายเป็นนิวเคลียสเบาที่ใหญ่กว่าเดิม ในปัจจุบันเชื่อกันว่าบนดาวฤกษ์ต่างๆ พลังงานมหาศาลที่ปล่อยออกมาเกิดจากปฏิกิริยาฟิวชั่นทั้งสิ้น
ปฏิกิริยาฟิวชัน
ตัวอย่างของปฏิกิริยาฟิวชั่นที่ทำได้ในห้องปฏิบัติการ
1. 
2. 
3. 
4. 
ตัวอย่างของปฏิกิริยาฟิวชั่นที่เกิดขึ้นบนดาวฤกษ์
1. 
2. 
3. 
4. 
ข้อสังเกต
จะเห็นว่าในแต่ละปฏิกิริยาของฟิชชั่นและฟิวชั่นเมื่อเทียบพลังงานแล้ว ในฟิชชั่นหนึ่งปฎิกิริยาจะให้พลังงานมากกว่าฟิวชั่นหนึ่งปฏิกิริยา แต่ในขนาดมวลที่พอกันของสารที่ทำให้เกิดฟิวชั่น กับ สารที่ทำให้เกิดฟิชชั่น จำนวนปฏิกิริยาฟิวชั่นจะมากกว่าฟิชชั่นมากเป็นผลทำให้พลังงานรวมที่ได้จากฟิวชั่นมากกว่าฟิชชั่นนั่นเอง
ข้อควรจำ
1) ปฏิกิริยาฟิชชั่น 1 ปฏิกิริยา จะให้พลังงานมากกว่าปฏิกิริยาฟิวชั่น 1 ปฏิกิริยา
2) ขนาดของมวลนิวเคลียสที่เท่ากันเข้ากันทำปฏิกิริยาฟิชชั่นและปฏิกิริยาฟิวชั่น พลังงานที่เกิดจากปฏิกิริยาฟิวชั่นจะมากกว่าพลังงานที่เกิดจากปฏิกิริยาฟิชชั่น
ไอโซโทป
เลขมวล เลขอะตอมและสัญลักษณ์ของนิวเคลียร์
นิวคลีออน คือ อนุภาคที่รวมตัวกันอยู่ภายใต้ นิวเคลียส ซึ่งหมายถึง โปรตอน (proton,  ) และนิวตรอน (Neutron,
) และนิวตรอน (Neutron,  ) ในนิวเคลียสมีสัญลักษณ์เป็น
) ในนิวเคลียสมีสัญลักษณ์เป็น
โดยที่ X เป็นสัญลักษณ์ของนิวเคลียสใดๆ
A เป็นเลขมวล (Atom mass number) หมายถึงจำนวนนิวคลีออนทั้งหมดที่อยู่ในนิวเคลียส
Z เป็นเลขอะตอม หมายถึง จำนวนโปรตอนภายใน Nucleus
นิวไคลด์ (Nuclide) หรือธาตุ หมายถึงนิวเคลียสที่มีสมบัติบางอย่างเหมือนกัน สัญลักษณ์ของนิวไคลด์แทนด้วย  โดยที่ X แทน
โดยที่ X แทน
นิวไคลด์ใดๆ A แทนเลขมวล Z แทนเลขอะตอม เช่น 
ไอโซโทป (Isotope) หมายถึง นิวไคลด์หรือธาตุที่มีเลขอะตอมเท่ากันแต่มีเลขมวลต่างกัน เช่น  ,
,  ,
, 














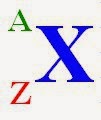
ไม่มีความคิดเห็น:
แสดงความคิดเห็น